Reaksi Amonia dengan Asam YouTube
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Asena 2508 Santa Clara Ave Alameda, CA 510.521.4100 DINNER Monday-Thursday: 5:00 p.m. - 9:00 p.m. Friday-Saturday: 5:00 p.m. - 10:00 p.m. Closed on Sundays

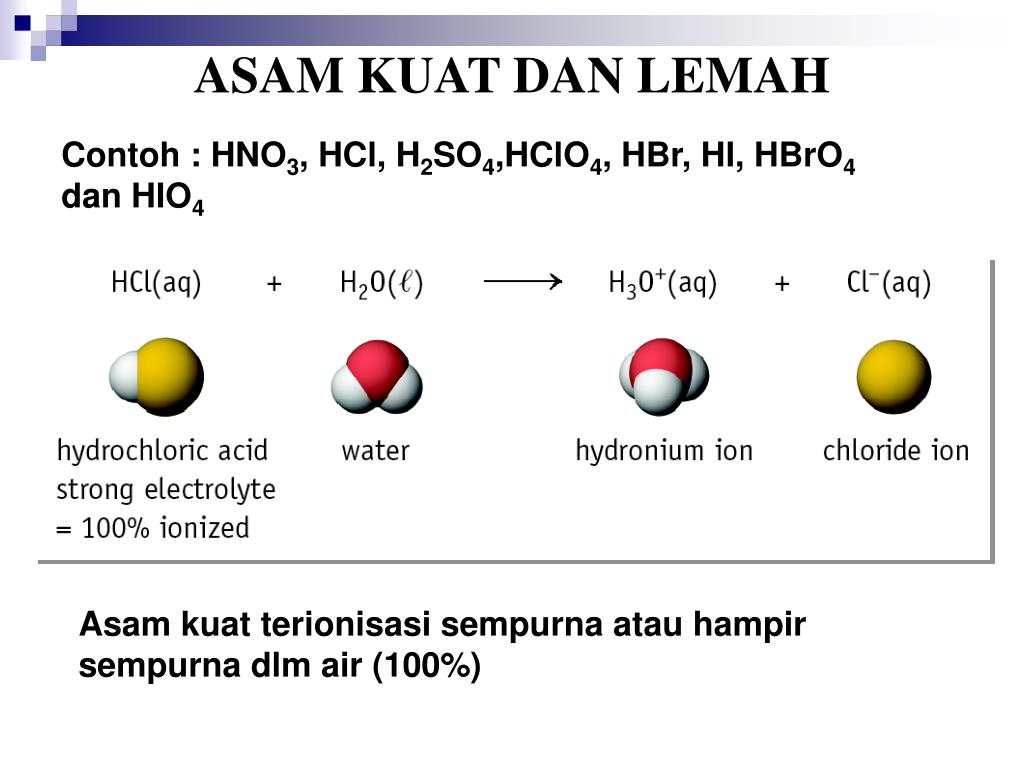
Daftar Asam Basa Kuat dan Lemah
Amonia adalah senyawa kimia dengan rumus NH3. Biasanya senyawa ini didapati berupa gas dengan bau tajam yang khas . Walaupun amonia memiliki sumbangan penting bagi keberadaan nutrisi di bumi, amonia sendiri adalah senyawa kaustik dan dapat merusak kesehatan. Administrasi Keselamatan dan Kesehatan Pekerjaan Amerika Serikat memberikan batas 15 menit bagi kontak dengan amonia dalam gas.

Pengertian Asam, Basa, Garam, Ciri, Sifat, Indikator & Contoh
Pacific Autism Center for Education (PACE) was founded in 1989 by parents, community members, and educators as a private 501 (c)3 non-profit to meet the critical need for high-quality programs for children and adults with autism. For over 30 years, PACE proudly provides services for individuals ranging in age from 3 - 60 years old in the Bay.

Kimia Asam Dan Basa
NH3 adalah rumus senyawa dari ammonia yang termasuk salah satu indikator pencemaran udara. Mayoritas senyawa ini dapat berbentuk gas yang baunya tajam. Meskipun demikian, amonia juga memiliki andil dalam menyumbang nutrisi di bumi. Umumnya, ammonia berasal dari mikroba, pengolahan batu bara, atau bahkan pengolahan limbah.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Ammonium sulfat bukanlah asam atau basa. Senyawa ini digunakan sebagai pupuk untuk tanaman dan dapat digunakan dalam produksi deterjen, kertas, dan tekstil. Penggunaan ammonium sulfat harus dilakukan dengan hati-hati dan mengikuti petunjuk penggunaan yang tertera pada kemasan. Hindari penggunaan yang berlebihan dan simpanlah senyawa ini dengan.

Cara Menentukan Senyawa Bersifat Asam Basa Atau Netral Digunakan
Dalam air, amonia dapat ada dalam bentuk yang tidak terionisasi (NH3) atau bebas. Amonia adalah zat yang juga dapat berada dalam bentuk terionisasi (NH4+) atau ion amonium. Amonia adalah zat yang berbahaya karena memiliki sifat yang toksik terhadap manusia dan makhluk hidup lainnya. Meski demikian, amonia adalah zat yang juga dapat dimanfaatkan.

Teori Asam Basa
Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Skala pH yang menunjukan suatu larutan bersifat asam atau basa (lumenlearning.com) KOMPAS.com - Asam merupakan zat yang menghasilkan ion hidrogen (H+) dalam larutan. Sementara basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air.

Reaksi Amonia dengan Asam YouTube
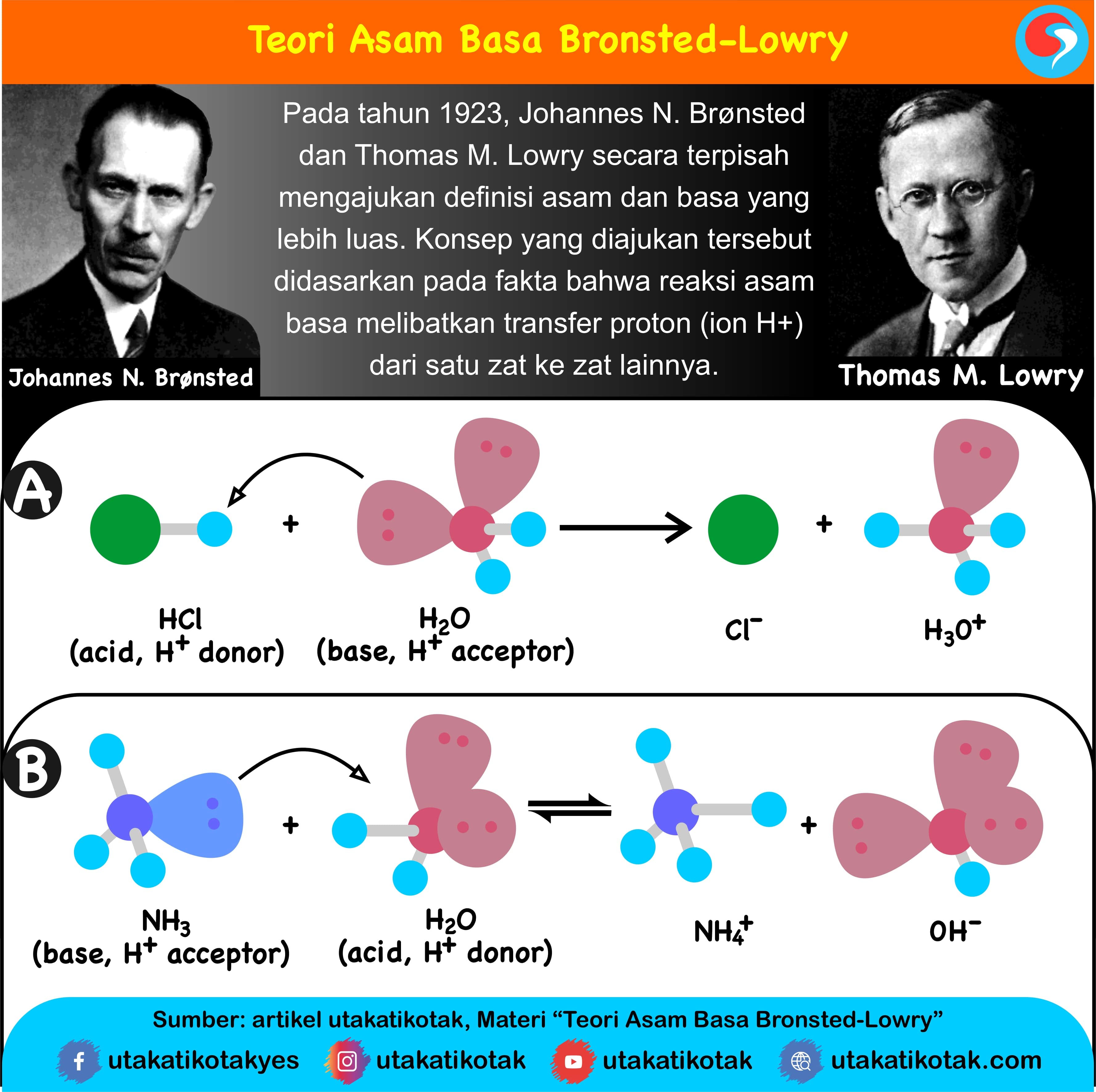
Teori Asam Basa Bronsted-Lowry. Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923 mengembangkan teori Arrhenius dengan nama teori asam basa Bronsted-Lowry. Dalam teorinya, Bronsted dan Lowry menjawab kekuranngan yang ada dalam teori Arrhenius yang tidak dapat menyimpulkan senyawa asam basa yang reaksinya tidak membentuk larutan.

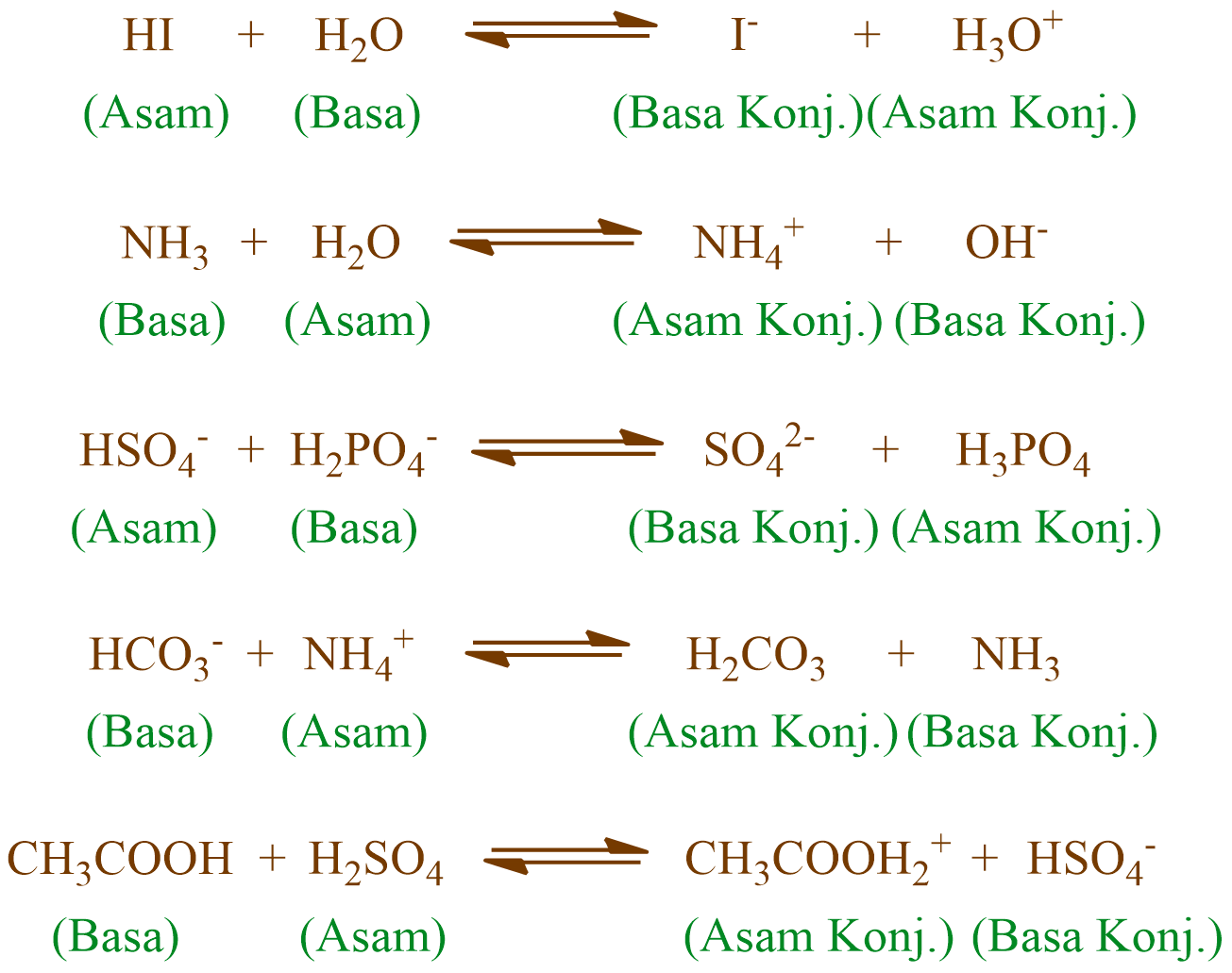
LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Ion amonium adalah asam lemah, bereaksi dengan basa Brønsted menghasilkan kembali molekul amonia yang tak bermuatan: Sehingga, perlakuan larutan pekat garam amonium dengan basa kuat menghasilkan amonia. Ketika amonia dilarutkan dalam air, sejumlah kecil amonia berubah menjadi ion amonium: Amonia membentuk ion amonium bergantung pada pH larutan.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Amonia Sebagai Senyawa Basa. Sifat basa dari amonia membuat senyawa ini dapat bereaksi dengan asam untuk membentuk garam. Misalnya, ketika amonia bereaksi dengan asam klorida (HCl), senyawa amonium klorida (NH4Cl) terbentuk. Reaksi ini bersifat eksotermik, yang berarti bahwa reaksi ini melepaskan panas.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
1.Amonia merupakan gas yang tidak berwarna namun berbau sangat menyengat. 2.Sangat mudah larut dalam air, dalam keadaan standar, 1 liter air mampu melarutkan 1180 liter amonia. 3.Amonia mudah mencair, amonia yang membeku pada suhu (-)78 derajat celsius menjadi cairan/kondisi normal pada temperatur 30-40 derajat celcius dan mendidih pada suhu.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Amonia, Sifat dan Manfaatnya. rumus hitung · Dec 5, 2014 · Leave a Comment. Amonia adalah salah satu jenis senyawa kimia yang secara alami ada di alam dan tubuh kita. Senyawa amonia terdiri dari satu atom nitrogen dan tiga atom hidrogen yang masing-masing berikatan kovalen dengan aton N. Senyawa amonia mempunyai rumus NH 3.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Sifat, Reaksi dan Pembuatan Amonia Amonia adalah salah satu senyawa nitrogen yang paling penting.Nitrogen adalah bagian dari protein dan asam nukleat dan merupakan salah satu komponen yang membentuk dasar kehidupan. Karena itu, penting untuk mempelajari cara mensintesis senyawa kimia dengan nitrogen. Pertama kali membuatnya menggunakan listrik, tetapi metode ini terbukti sangat mahal.
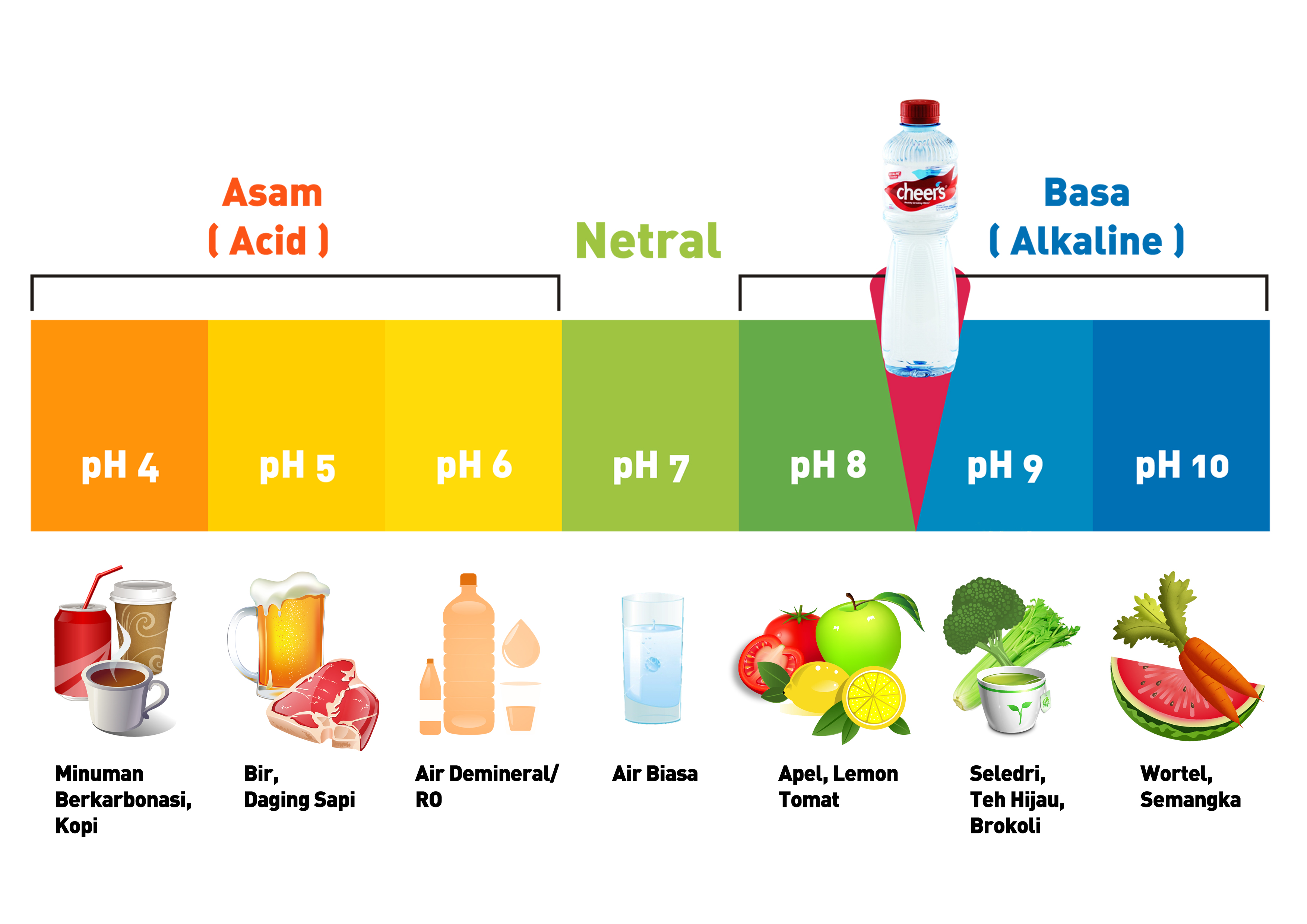
Indikator Asam Basa
Amonium hidroksida, dikenal pula sebagai larutan amonia, air amonia, larutan amoniakal, amonia encer, akua amonia, amonia berair, atau secara sederhana hanya disebut sebagai amonia, adalah larutan amonia dalam air.Senyawa ini disimbolkan sebagai NH 3 (aq). Meskipun nama amonium hidroksida menunjukkan suatu alkali dengan komposisi [NH 4 +][OH −], sebenarnya sangat sulit untuk mengisolasi.

Teori Asam Basa
Amonia adalah Asam atau Basa? Amonia adalah basa, bukan asam. Hal ini berarti bahwa amonia memiliki pH yang lebih tinggi dari 7.0. Ketika amonia dicampur dengan air, ia akan membentuk larutan basa. Larutan basa memiliki sifat kimia yang berbeda dengan larutan asam. Basa dapat membantu mengurangi keasaman lingkungan atau memperbaiki pH tanah.
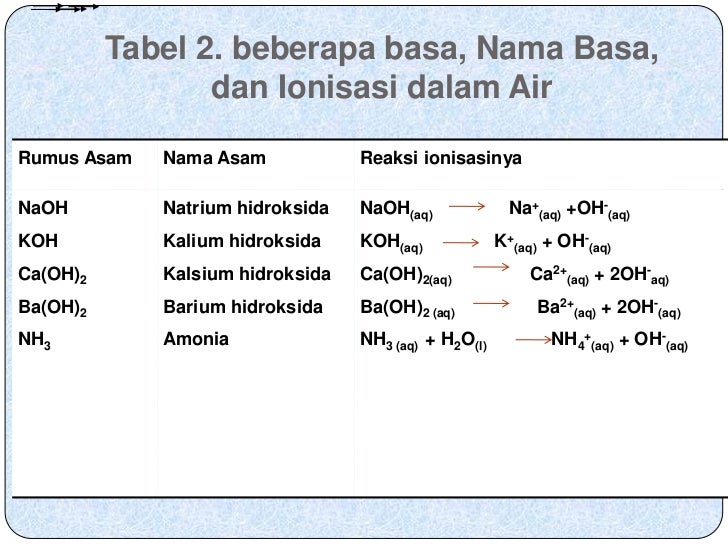
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Amonia adalah senyawa kimia yang dapat bersifat basa atau asam tergantung pada suasana lingkungannya. Ketika terkena asam, amonia akan bertindak sebagai basa dengan menerima ion H+ dan membentuk ion amonium (NH4+). Sebaliknya, dalam suasana basa, amonia akan bertindak sebagai asam dengan melepaskan ion H+. Namun, perlu diperhatikan bahwa sifat amonia sebagai asam atau basa tergantung pada.